Os pedidos foram apresentados sexta (8/1) pelo Instituto Butantan, para a vacina Coronavac, e pela Fiocruz, para a vacina de Oxford.

O que é uso emergencial?
É um pedido feito antes do registro final para aplicar a vacina em um grupo específico da população. Precisa ser enviado à Anvisa pela empresa fabricante ou importadora da vacina que esteja conduzindo a pesquisa no território brasileiro. Pode ser solicitado com a fase 3 da pesquisa clínica em andamento. O uso emergencial está definido pela resolução RDC 444/2020.
O que é avaliado no Uso Emergencial?
A avaliação do uso emergencial envolve aspectos como:
- Dados de eficácia, segurança já disponíveis dos estudos clínicos, ou seja, com seres humanos, inclusive os resultados provisórios.
- Dados de qualidade, estabilidade e armazenamento.
- Projetos de monitoramento das reações adversas.
- Avaliações de boas práticas de fabricação, voltada para a linha de produção de onde sair o medicamento.
- Autorizações e licenciamento das importações.
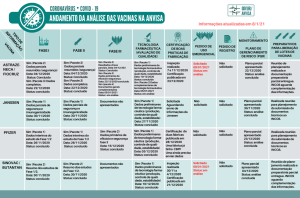
Andamento da análise das vacinas na Anvisa
Confira o andamento da submissão de documentos apresentados pelas empresas desenvolvedoras. Sempre que houver mudanças no cenário, os dados desta página serão atualizados.
Entenda cada uma das fases da imagem:
- Fase 1 – essa é a primeira etapa de testes em humanos para avaliar a segurança e possíveis reações indesejáveis no local da aplicação da vacina ou no organismo. Nessa fase também pode ser verificada, de forma preliminar, a imunogenicidade da vacina, ou seja, sua capacidade de gerar anticorpos contra o novo coronavírus.
- Fase 2 – é hora de avaliar a dose, a forma de vacinação e a capacidade de gerar anticorpos (contra o novo coronavírus) na população (faixa etária, por exemplo) que deverá ser indicada para receber a vacina. A segurança continua em análise aqui.
- Fase 3 – os testes nessa etapa são realizados em grandes populações para avaliar a segurança e a eficácia da vacina. A vacina precisa provar que, de fato, é capaz de nos proteger da doença.
- Fase 4 – é o estudo pós comercialização, em que é analisado o que ocorre já com a vacina disponível as pessoas.
“Posso tomar as vacinas contra o coronavírus (SARS-CoV-2)?”
A pergunta mais repetida pelos pacientes em imunossupressão
Não existe uma recomendação absoluta, dado a ausência de evidências publicadas, até a presente data, sobre segurança e eficácia das vacinas contra SARS-CoV-2 nesta população até o momento atual.
Decisão Compartilhada – A decisão sobre a vacinação contra SARS-CoV-2 dos pacientes em imunossupressão e/ou com doenças imunomediadas, deve ser, preferencialmente, compartilhada com o médico assistente.
Todas as plataformas utilizadas para a produção das vacinas contra SARS-CoV2, que finalizaram a fase 3 e têm seus resultados publicados (como especificado na imagem abaixo), são consideradas potencialmente seguras para a vacinação dos pacientes em imunossupressão. Uma vez que as plataformas utilizadas no desenvolvimento destas vacinas não envolvem vírus vivos atenuados.
Entretanto, devem ser observadas as peculiaridades dos resultados dos estudos, assim como as recomendações dos fabricantes.
Além disso, vale ressaltar que em nenhum dos ensaios clínicos de fase 3 houve a inclusão de pacientes com comprometimento do sistema imune, seja por doenças imunomediadas seja pelo uso de imunossupressores.
Fontes:
Anvisa está avaliando dois pedidos de uso emergencial de vacina
Andamento da análise das vacinas na Anvisa
Entenda como acontece o estudo clínico de uma vacina
Força-Tarefa para Gerar as Orientações de Vacinação contra SARS-CoV-2 para Pacientes com Doenças Reumáticas Imunomediadas (DRIM)
